南开团队在细胞外囊泡与受体细胞相互作用机制取得新进展
南开大学医学院岳世静副教授联合化学院肖乐辉教授课题组在国际著名学术期刊《JExtracell Vesicles》发表题为HighTSPAN8 expression in epithelial cancer cell-derived smallextracellular vesicles promote confined diffusion and pronounceduptake的研究论文。研究团队通过基因工程手段调节乳腺癌细胞表达四次跨膜蛋白8(Tetraspanin 8, TSPAN8),通过表达TSPAN8乳腺癌细胞来源的微小细胞外囊泡(smallextracellular vesicles,sEVs)与靶细胞的相互作用,研究TSPAN8分子对sEVs在靶细胞膜表面的扩散和转运特性的影响。运用单粒子追踪技术证明TSPAN8分子通过对sEVs的限制性扩散显著促进与受体细胞的结合。进一步功能分析表明,表达TSPAN8的sEVs显著促进了癌细胞的运动性和上皮间充质样转化(epithelial-mesenchymaltransition, EMT)。该研究有利于明确TSPAN8分子修饰sEVs为药物递送系统应用提高效率。

近年来,sEVs由于其特异优势而被广泛的应用于疾病的诊断与治疗。sEVs包装大量的生物活性分子可以通过血流输送至机体多种器官组织。sEVs在细胞间通讯中具有关键调节作用,sEVs装载大量生物活性分子可能会影响受体细胞的表型和功能。有研究表明sEVs荷载分子可以调控生理或病理微环境靶细胞的表型。上皮样癌细胞来源的sEVs富集CD151或TSPAN8与整合素Integrins分子相互作用形成复合物,可促进肿瘤进展。然而,有关sEVs与受体细胞的结合过程及相关分子调节机制还不明确。
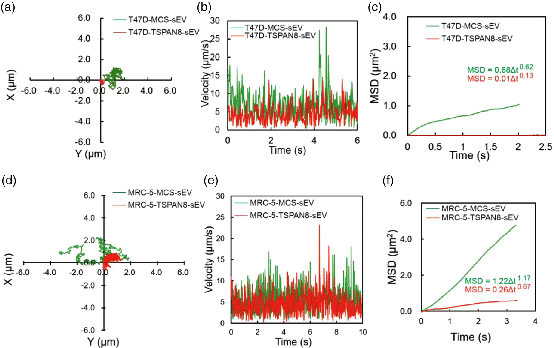
TSPAN8改变sEVs在靶细胞表面的扩散模式
本研究首次证明TSPAN8分子可以促进sEVs与受体细胞的限制性扩散,进而提高靶细胞的摄取并促进肿瘤细胞的迁移和EMT并诱导肿瘤转移。体内研究表明,表达TSPAN8的sEVs显著促进了肝脏、肺和脾脏中的结合和滞留。该研究表明TSPAN8通过加强限制性扩散促进sEVs与靶细胞间的相互作用,并显著促进细胞的运动。因此,表达TSPAN8的sEVs可作为重要的直接或间接肿瘤治疗靶点。
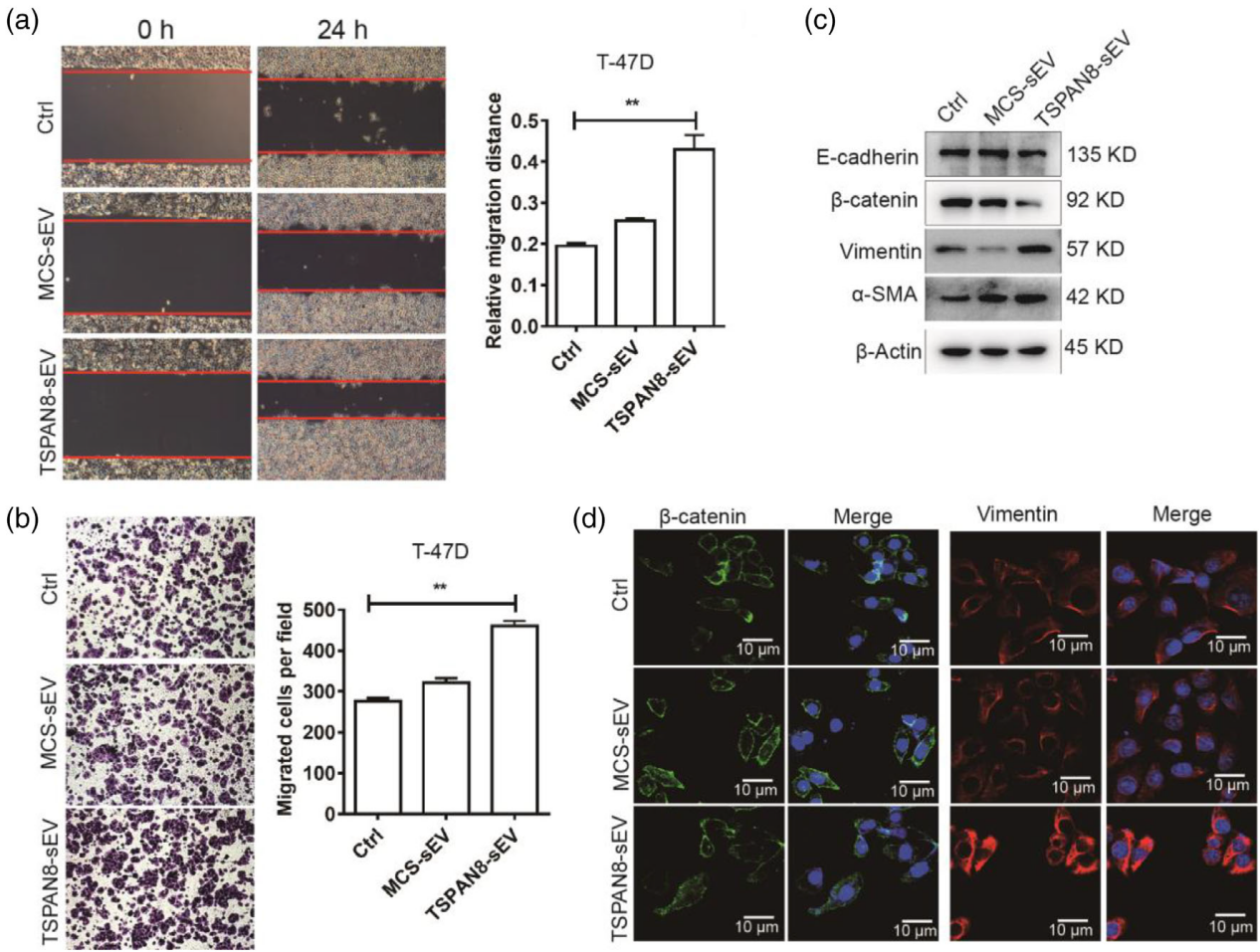
富集TSPAN8的sEVs促进受体细胞的迁移和EMT转变
本文第一作者为南开大学医学院硕士研究生王腾、南开大学化学院博士研究生王鑫和成都第三人民医院的王浩斌副主任医师。医学院硕士研究生李路瀚和张陈红深度参与了本研究。南开大学化学院肖乐辉教授和南开大学医学院岳世静副教授为共同通讯作者,南开大学为第一完成单位。
该研究得到了国家自然科学基金委的项目资助。





