中青在线:南开大学发现“抗艾”药物全新靶点
中青在线天津12月1日电(中国青年报·中青在线记者 张国 通讯员 吴军辉) 南开大学医学院的一支课题组最近成功发现了一个新的人体宿主细胞编码的蛋白——卷曲螺旋结构蛋白8(简称CCDC8),该蛋白具有很强的抗1型艾滋病病毒(HIV-1)活性,可以大幅度降低病毒产量,最低可降至原来的三十分之一。这一发现为“抗艾”药物的研制提供了全新靶点。
人类至今没有发现彻底治愈艾滋病的疗法,而HIV病毒的多变性令疫苗研制工作举步维艰。各类抗病毒药物的主要原理就是抑制感染者体内HIV病毒的复制。长期致力于艾滋病毒研究的南开大学医学院教授魏民领导的课题组,在实验过程中偶然发现人体细胞膜上的CCDC8蛋白具有很强的抑制HIV病毒的活性。
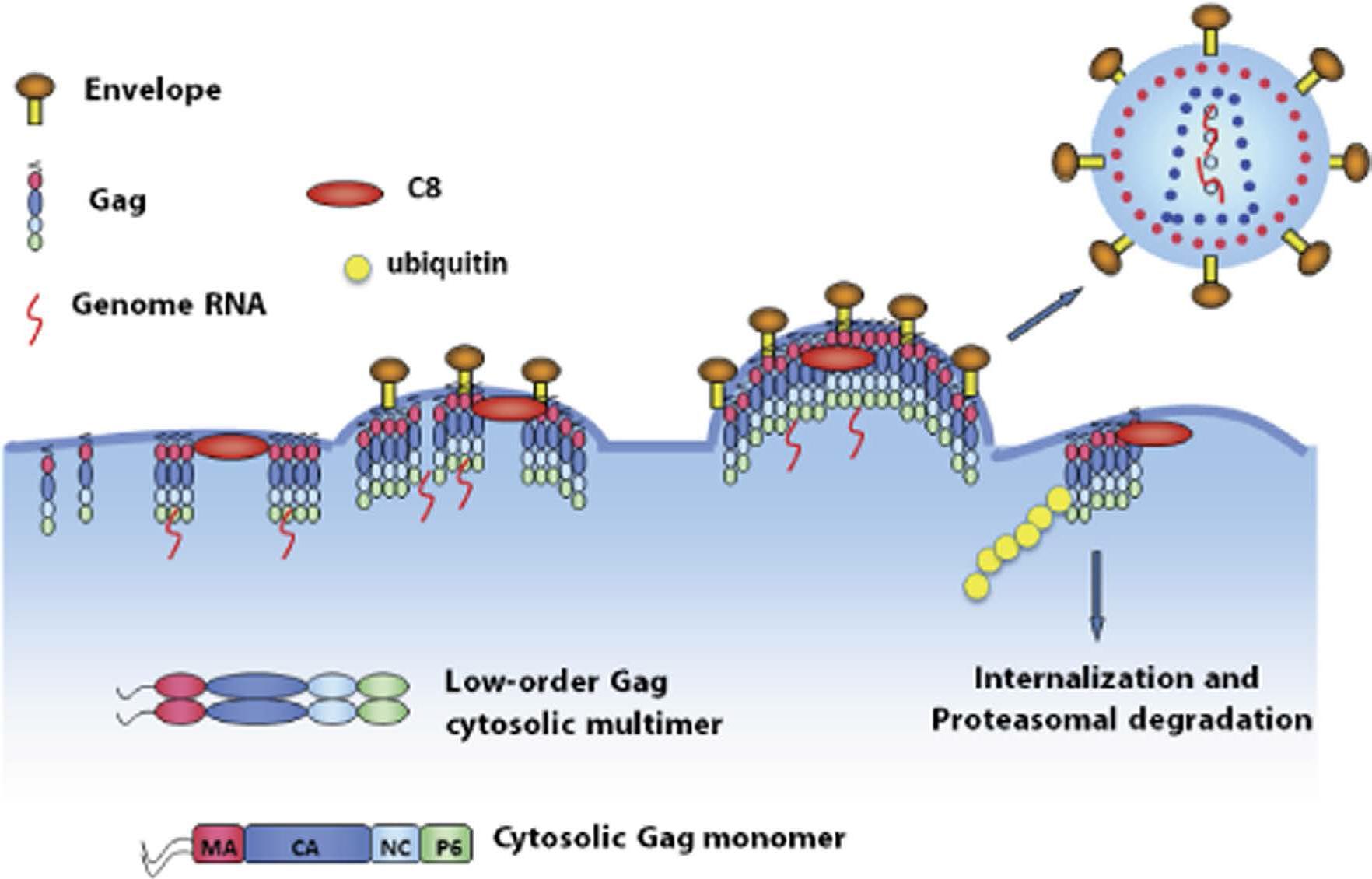
据介绍,正常情况下,人体感染HIV病毒后,病毒会侵入人体细胞内部大量复制,然后释放到细胞外。其过程为,在病毒基因组“指导”下,宿主细胞会在细胞浆中合成一种名为“Gag”的结构蛋白。这种蛋白是构成HIV病毒骨架的主要“原料”。Gag蛋白会大量聚集到细胞膜上形成多聚体并向细胞外侧彭出,即“出芽”。随后,病毒“半成品”包裹一段病毒基因组脱离宿主细胞,最终形成一个完整的病毒颗粒。
而科研人员在实验中发现,CCDC8能够改变HIV病毒的复制过程。当Gag蛋白在细胞膜上与CCDC8相遇后,其“组装”过程受到抑制。同时,CCDC8通过联合其他蛋白,如细胞骨架蛋白Obsl1和E3泛素连接酶Cul7,诱导Gag蛋白的内吞、多泛素化和降解。通俗来讲,构成HIV病毒骨架的Gag蛋白在CCDC8的作用下,不再向外“出芽”,而是被细胞“内吞”,进而被分解。这样,HIV病毒的复制就可以被有效抑制,患者病情进而得到控制。
“CCDC8存在于正常的人体细胞膜上,只是量比较少,难以抑制HIV病毒复制。我们通过外源载体表达技术,提升了CCDC8的表达量之后,实验细胞的抗HIV病毒活性明显提升。我们有理由相信,CCDC8完全可以成为一个新的抗艾药物靶点。”魏民介绍,CCDC8诱导HIV-1 Gag的内吞、多泛素化和降解,这一机制在HIV-1研究的30多年过程中从未被发现,具有极大的新颖性。
“CCDC8的应用领域很广。它与HIV、肿瘤、3M综合症等疾病都有很大的关系。”魏民说,课题组将继续从事CCDC8功能、机理的研究。
该课题组已在国际学术期刊发表了有关论文并在国内申请了专利。





